Томас Жирод, MSc, Шарлотта Жане, PhD, Мэдисон Баргманн, MSc, Патрик Лаурен, PhD, Имад Абу, PhD, университет Экс-Марсель, Национальный центр научных исследований Франции (CNRS), стоматологическое отделение госпиталя Де Ла Тимоне (Марсель, Франция).
Цель. При стимуляции липотейхоевой кислотой или при травме фибробласты играют важную роль в инициировании воспалительной реакции и заживлении тканей пульпы путем секреции белков системы комплемента и факторов роста. Материалы для прямого покрытия пульпы, оказывая влияние на эти клетки, могут влиять на воспалительные процессы, и процессы заживления в ограниченном пространстве полости зуба. Цель данного исследования in vitro заключалась в изучении противовоспалительной активности и влияния на процесс заживления тканей пульпы материалов на основе трикальций силиката при прямом покрытии.
Материалы и методы. Влияние материалов Biodentine (Septodont), TheraCal (Bisco Dental) и Xeno III (Dentsply Sirona) изучали на фибробластах, стимулированных липотейхоевой кислотой, а также на физически поврежденных фибробластах. Уровни секреции цитокинов (интерлейкин 6, фактор роста эндотелия сосудов, фактор роста фибробластов 2 и трансформирующий фактор роста бета-1) измеряли с помощью иммуноферментного анализа. В исследовании in vitro изучили адгезию воспалительных THP-1 к эндотелиальным клеткам, их миграцию и активацию. Пролиферацию фибробластов пульпы исследовали с помощью МТТ-теста, а их миграцию к поврежденному участку изучали с помощью анализа заживления царапин.
Результаты. Секреция фактора интерлейкина 6 и фактора роста эндотелия сосудов увеличивалась со всеми материалами, но в меньшей степени с Biodentine. Секреция фактора роста фибробластов 2 и трансформирующего фактора роста бета-1 были значительно выше с Biodentine, чем со всеми другими материалами. Клеточная адгезия THP-1 к эндотелиальным клеткам и их активация были снижены в группе Biodentine и TheraCal. Однако миграция уменьшилась только в группе Biodentine. Пролиферация фибробластов через 6 дней значительно увеличилась в группе Biodentine, но значительно снизилась в группе Xeno III. Кроме того, только Biodentine индуцировал миграцию фибробластов в место повреждения как показал скретч-анализ.
Выводы. Результаты данного исследования подтверждают, что материалы для покрытия пульпы влияют на начальные стадии воспаления и заживления пульпы. Biodentine обладает самым высоким потенциалом для заживления пульпы, а также проявляет противовоспалительную активность по сравнению с материалами, содержащими мономер. Это подчеркивает преимущества выбора этого материала для прямого покрытия пульпы
Ключевые слова: материалы для покрытия пульпы, заживление пульпы, воспаление пульпы, трикальций силикаты.
Материалы для прямого покрытия пульпы влияют на процессы воспаления и заживления. В то время как трикальций силикаты сдвигают равновесие в сторону восстановления и заживления, материалы, содержащие мономер, приводят к воспалению. Авторы не рекомендуют применять материалы, содержащие смолу, для прямого покрытия пульпы.
Глубокие кариозные или механические поражения могут привести к травмам пульпы. Впоследствии, как и бактерии, проникающие в пульпу, так и поврежденные ткани инициируют воспалительную реакцию.1
Воспалительное действие подразумевает секрецию цитокинов, которые привлекают клетки иммунной системы. Эти клетки взаимодействуют с эндотелием сосудов и мигрируют к поврежденной ткани по градиенту хемотаксиса, чтобы окончательно активироваться в качестве макрофагоподобных клеток.2 Многие цитокины, такие как интерлейкин 6 (IL-6), интерлейкин 8 (IL-8) и интерлейкин 1 бета (IL-1b), участвуют в воспалительных процессах. Другие, такие как фактор роста эндотелия сосудов (VEGF), играют роль как при вазодилатации сосудов после начала воспаления, так и в васкуляризации ткани пульпы во время регенеративных процессов после гипоксии пульпы.3
Восстановление и заживление пульпы обеспечивается пролиферацией фибробластов и стволовых клеток и их миграцией к месту повреждения для обновления потерянной ткани на начальной стадии воспалительной реакции. Ранее было показано, что многие из этих событий регулируются местными факторами. Многие факторы роста, участвующие в этих стадиях, либо присутствуют в дентине, и выделяются из-за кислой среды во время кариозного процесса, или выделяются клетками пульпы.4–6 Было показано, что рансформирующий фактор роста бета-1 (TGF-β1) играет ключевую роль в миграции и дифференциации стволовых клеток пульпы зуба,7,8 тогда как фактор роста фибробластов 2 (FGF-2) играет важную роль в регенерации комплекса тканей дентина и пульпы, стимулируя пролиферацию и миграцию клеток пульпы.9
Кроме того, недавние данные подтвердили участие белков системы комплемента в поддержании баланса воспаления и регенерации пульпы путем секреции активных молекул, таких как C3a, C5a, и мембраноатакующий комплекс в ограниченном пространстве полости зуба.10–12 Кроме того, было показано, что материал для покрытия пульпы может регулировать секрецию С5а.13
Трикальций силикаты сегодня признаны материалами выбора для терапии пульпы, потому что гистологические исследования продемонстрировали регенерацию пульпы без воспаления в условиях in vivo14 и в зубах человека.15,16 Модификации таких материалов, направленные на ускорение отверждения, привели к разработке светоотверждаемых трикальций силикатов, таких как TheraCal (Bisco Dental). Однако наличие высокого процента мономера в этом материале вызывает вопросы о возможных последствиях для воспалительной реакции пульпы из-за его токсичности.16,17
Терапевтический эффект от использования этих материалов при прямом покрытии пульпы обусловлен непосредственным влиянием на подлежащие фибробласты, которые, как сообщается, играют значительную роль в инициировании воспаления и регенерации пульпы. Кроме того, фибробласты клетки производят и выделяют активные белки, такие как C3a и C5a, известные как анафилаксины, которые вызывают увеличение проницаемости сосудов, и выделения тучных клеток на начальной стадии воспаления18 и стволовых клеток пульпы на стадии регенерации.12,19 Фибробласты пульпы также выделяют VEGF, тромбоцитарный фактор роста и FGF-2, который непосредственно влияет на ангиогенез сосудов пульпы. Предыдущие исследования механического повреждения клеток или воздействия липотейхоевой кислотой (LTA), компонентом грамположительных бактерий, продемонстрировали значительное увеличение секреции этих молекул. Это подчеркивает связь между стимуляцией фибробластов и инициированием воспалительной реакции или процесса регенерации.4,20,21
Цель данного исследования in vitro заключалась в изучении влияния материалов на основе трикальций силиката на стимуляцию фибробластов пульпы и участие в начальных стадиях воспаления и восстановления пульпы, а также оценка последствий добавления мономеров в такие материалы на эти процессы.
Biodentine (Septodont) и TheraCal (Bisco Dental) – это материалы на основе трикальций силиката, но TheraCal также содержит мономер для обеспечения светоотверждения. Xeno III (Densply Sirona) представляет собой систему для бондинга композитов, используемую в качестве контроля. Элюаты вышеупомянутых материалов применялись на LTA-стимулированных и физически поврежденных фибробластах. Авторы оценивали секрецию фибробластов цитокинов, участвующих в воспалении (IL-6, VEGF) и регенерации (TGF-b1, FGF-2), а также изучали адгезию воспалительных клеток на эндотелиальных клетках, их миграцию и активацию.
МАТЕРИАЛЫ И МЕТОДЫ
Реактивы
Среда, реагенты и материалы для клеточной культуры были получены от Dutscher (Франция).
Культура фибробластов пульпы
Первичные клетки пульпы зуба человека получили из несформированных третьих моляров, удаленных по ортодонтическим показаниям (пациенты – мужчины и женщины моложе 18 лет) в соответствии с французским законодательством (информированное согласие пациентов и одобрение экспертным советом протокола исследования) методом выращивания вне организма.22 После сортировки мезенхимальных стволовых клеток с маркером STES-1,12 удалили стволовые клетки пульпы. Оставшаяся популяция STRO-1 негативных клеток характеризовалась как фибробласты. Вкратце, они были положительными для поверхностного белка фибробластов и отрицательными для Nanog, Oct3 / 4, Sox 2, Klf 4, CD 44, CD90, CD 105, CD 146 и CD 166.10,21 Эти фибробласты выращивали в среде МЭМ, дополненной 10 %-ной эмбриональной бычьей сывороткой, 100 ед/мл пенициллина, 100 мг/мл стрептомицина и 0,25 мг/мл амфотерицина В.
Подготовка среды для выращивания клеток
Материалы были подготовлены в соответствии с инструкциями изготовителей и вставлены в стандартизованные силиконовые формы. Образцы материалов стерилизуют с помощью УФ (20 мин с каждой стороны) и инкубируют в бессывороточной среде MEM (0,05 см2/мл) в течение 24 ч при 37°С, 5 % СО2.13 Эти среды в дальнейшем будут называться средами для выращивания. В качестве контроля использовали среду MEM.
Обработка фибробластов
Для имитации бактериальной инфекции при кариозных поражениях фиброзные культуры (30 000 клеток/см2) стимулировали с 1 мг/мл LTA в течение 4 ч. Кроме того, были нанесены физические травмы для имитации повреждения клеток во время процесса подготовки полости. Это делалось стерильными скальпелями в вертикальном и горизонтальном направлениях (по 10 в каждом направлении на 6-луночных пластинах и по 5 на каждой в 12-луночных пластинах) в бессывороточной среде МЭМ. Для ясности эти LTA-стимулированные и поврежденные фибробласты будут в дальнейшем упоминаться как обработанные фибробласты.
Токсичность среды
Обработанные фибробласты инкубировали в среде МЕМ. Через 4, 24 и 48 ч удалили надосадочную жидкость, и провели MTT-тест (Sigma-Aldrich), как описано ранее,8 с субстратом МТТ (3- (4,5-диметилтиазол-2- ил) -2,5-дифенилтетразолия бромида).
Секреция цитокинов обработанными фибробластами
Обработанные фибробласты культивировали в кондиционированной или контрольной среде МЕМ в 12-луночных пластинах. Через 4, 24 и 48 ч надосадочные жидкости использовали для количественной оценки цитокинов (IL-6, VEGF, TGF-b1 или FGF-2) с помощью иммуноферментного анализа с использованием наборов Duoset (R & D Systems) в соответствии с инструкциями от производителя. Результаты выражены в мкг/мл.
Культура эндотелиальных клеток пупочной вены человека и воспаленных клеток THP-1
Эндотелиальные клетки пупочной вены человека (HUVEC) (PromoCell) культивировали в среде для роста эндотелиальных клеток 2 (PromoCell). Клетки THP-1 из моноцитарной клеточной линейки человека (Sigma), культивировали в RPMI (с добавлением 10 %-ной эмбриональной бычьей сыворотки, 100 ед/мл пенициллина, 100 мг/мл стрептомицина, 0,25 мг/мл амфотерицина В, 2 ммоль / л L-глутамина и 1 ммоль / л пирувата натрия), как описано.23
ПОСЛЕДОВАТЕЛЬНОСТЬ НАБОРА КЛЕТОК THP-1
Адгезия THP-1 на эндотелиальных клетках
Конфлюэнтные HUVEC (80 000 клеток/см2) культивировали в течение 4 ч в 6-луночных планшетах с надосадочной жидкостью из обработанных фибробластов, культивированных в кондиционированной или контрольной среде MEM в течение 24 ч. Клетки THP-1 сначала инкубировали с 0,1 ммоль/л кислоты BCECF (20,70-бис- (2-карбоксиэтил) -5- (и -6) -карбоксифлуоресцеин) в течение 1 ч. Суспензию BCECF, помеченную THP-1 (25 000 клеток/мл), наносят на монослой HUVEC в течение 30 мин при мягком орбитальном перемешивании. Затем срезы удаляли, а монослои HUVEC промывали 4 раза фосфатно-буферным солевым раствором с кальцием и магнием (PBS). Адгезивные клетки THP-1 подсчитали в 5 случайных полях с использованием флуоресцентного микроскопа (×100). Результаты выражаются в процентах от контроля.
Анализ перемещения клеток THP-1
Анализ проводили в камерах Бойдена. Обработанные фибробласты высевали в нижние камеры (12-луночные пластины) с 1 мл контрольной среды MEM. Верхние камеры высевали клетками THP-1 с концентрацией 25 000 в 100 мл. Клетки THP-1 активировали ацетатом фосборамиристата (400 нг/мл, 24 ч) перед миграцией. Через 24 ч мигрирующие клетки на нижней стороне мембраны вставки фиксировали (15 мин, 70 мл холодного этанола) и окрашивали эозином (20 мин). Мигрирующие клетки подсчитывали в 5 случайных полях с использованием световой микроскопии (×100). Результаты выражаются в процентах от контроля.
Активация клеток THP-1
Суспензию THP-1 (25 000 клеток/мл) культивировали 24 ч в 12-луночных пластинах с надосадочной жидкостью из обработанных фибробластов, культивированных в течение 24 ч в контрольной среде MEM. Затем лунки промывали 4 раза раствором PBS. Это обеспечивает удаление мертвых клеток и позволяет только адгезию живых клеток THP-1. Ядерные клеточные ядра окрашивали (20 мин) DAPI (40,6-диамидино-2-фенилидолом), а количество активированных (адгезивных) клеток подсчитывали в 5 случайных полях с использованием флуоресцентного микроскопа (×100). Результаты выражаются в процентах от контроля.
Пролиферация фибробластов пульпы
Фибробласты пульпы культивировали с низкой плотностью (1000 клеток/см2) в 12-луночных пластинах в течение 24 ч. По истечении этого периода среду заменяли надосадочной жидкостью из обработанных фибробластов, культивированных в течение 24 ч в среде MEM. Через 3, 6 и 9 дней надосадочную жидкость удаляли и проводили MTT-тест для измерения клеточной пролиферации.24 Результаты выражаются в процентах от контроля на 3-й день, который рассматривается как базовый.
Скретч-тесты по заживлению фибробластов
Конфлюэнтные фибробласты (30 000 клеток/см2) в 6-луночных пластинах были повреждены наконечником пипетки и инкубированы с надосадочной жидкостью из обработанных фибробластов, культивированных в течение 24 ч в среде МЕМ. После 12 ч инкубации клеточные ядра окрашивали с DAPI 1 мг/мл (20 мин), а мигрирующие клетки в поврежденную зону подсчитали в 5 случайных полях под флуоресцентным микроскопом (×100). Результаты выражаются в процентах от контроля.
Статистический анализ
Все эксперименты проводили трижды и повторяли 3 раза. Данные выражаются как среднее стандартное отклонение от среднего значения. Для определения статистической значимости (P < 0,05) применили t-тест Стьюдента.
РЕЗУЛЬТАТЫ
Материалы для покрытия пульпы не токсичны для фибробластов
Не отмечено статистически значимой разницы в жизнеспособности обработанных фибробластов, культивируемых в присутствии материалов для прямого покрытия, по сравнению с контролем независимо от времени инкубации (данные не показаны).
Биоматериалы, модифицированные секрецией цитокинов
Применение всех сред на обработанных фибробластах привело к значительному увеличению секреции IL-6. Однако это увеличение было значительно ниже с Biodentine независимо от периода инкубации (рис. 1A). Секрецию VEGF отметили при всех условиях. Эта секреция увеличивалась со всеми материалами, но была значительно выше с материалами, содержащими смолу (TheraCal и Xeno III) (рис. 1B). Biodentine индуцировал значительно более высокую секрецию TGF-b1 через 24 и 48 ч, тогда как уменьшение наблюдалось с TheraCal и Xeno III через 24 ч (рис. 1C). Наконец, быстрое увеличение секреции FGF-2 наблюдалось через 4 часа со всеми материалами, однако с Biodentine уровень был значительно выше независимо от периода инкубации.
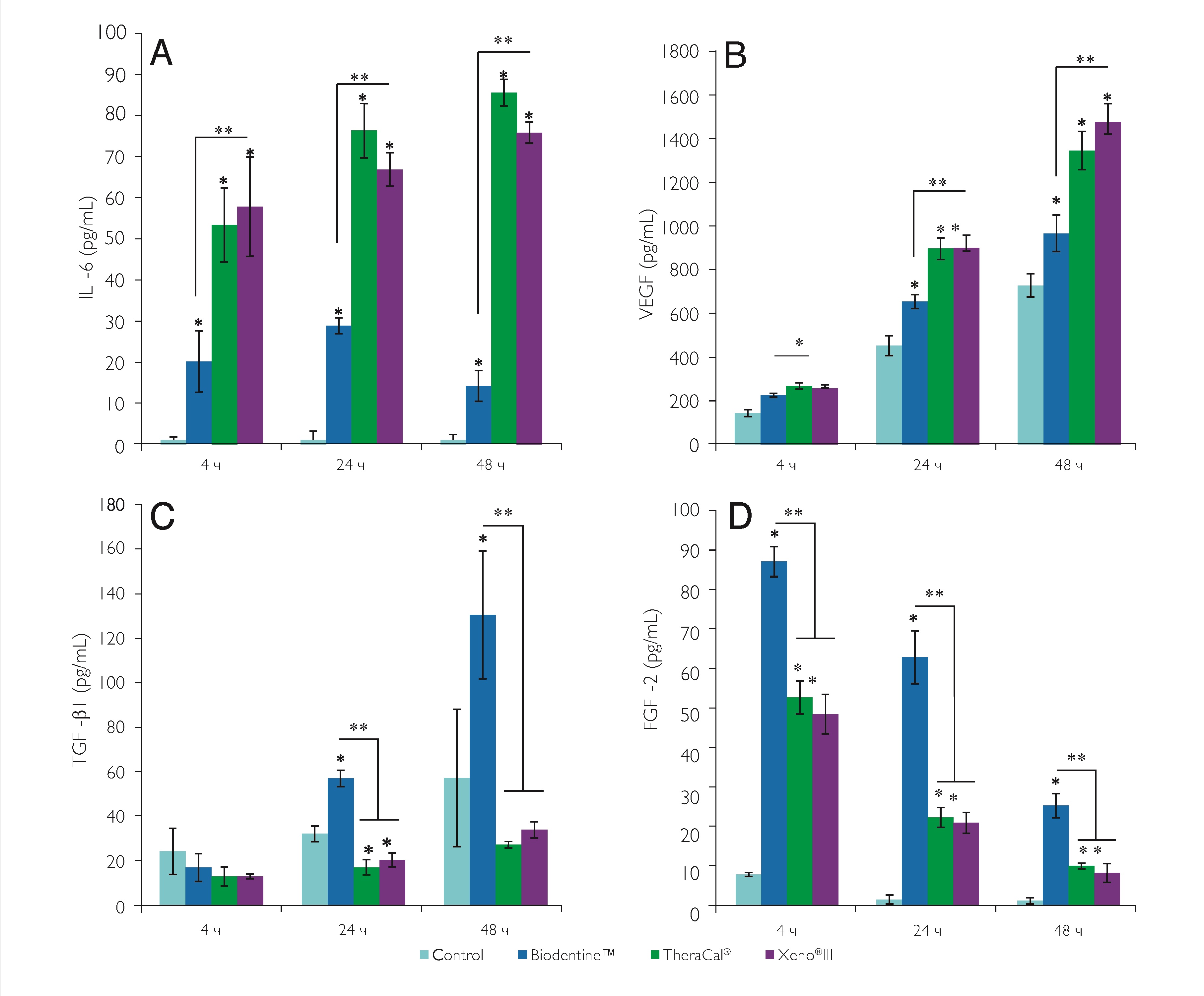
Рис. 1. Влияние биоматериалов на секрецию цитокинов. A – секреция IL-6 обработанными фибробластами значительно увеличилась во всех средах с биоматериалами независимо от времени инкубации. Эта секреция была значительно ниже с Biodentine; B – все условия инкубации привели к значительному увеличению секреции VEGF. Через 24 и 48 ч секреция была статистически выше во всех средах по сравнению с контролем, но в меньшей степени с Biodentine; C – обработанные фибробласты секретировали значительно больше TGF-b1 через 24 и 48 ч только при инкубации с Biodentine; D – обработанные фибробласты, инкубированные со всеми средами, показали значительное увеличение FGF-2 по сравнению с контролем, но этот уровень был выше с Biodentine по сравнению с TheraCal и Xeno III. Результаты выражены в мкг/мл.
* Значительная азница по сравнению с контролем; ** существенные различия между двумя условиями (P < 0,05).
Накопление и регуляция активности тучных клеток
Адгезия тучных клеток THP-1 на монослое HUVEC представлена на рис. 2А) и проиллюстрирована на изображениях по пересчету клеток (рис. 2B, a–d). Адгезия клеток THP-1 значительно уменьшалась при культивировании HUVEC в среде с Biodentine и TheraCal. Адгезия с Biodentine была слабее, чем у TheraCal. Xeno III значительно улучшил адгезию по сравнению с контролем и другими материалами (рис. 2C). Перенос клеток THP-1 значительно снизился только в среде с Biodentine (рис. 3A). Для подсчета клеток использовали изображения THP-1 (рис. 3B, a–d). Активация клеток уменьшалась с материалами, содержащими силикаты, в средах Biodentine и TheraCal, тогда как с Xeno III она увеличивалась (рис. 3B, e). Тем не менее, значительно более высокий уровень был получен с Biodentine по сравнению с TheraCal и Xeno III независимо от периода инкубации (рис. 1D).
Материалы, регулирующие пролиферацию и миграцию фибробластов пульпы
Повышенная пролиферация фибробластов была отмечена в среде Biodentine во все периоды инкубации (рис. 4А), а также отметили значительно повышенную колонизацию фибробластов в области повреждения (рис. 4B, a–e). В среде с Xeno III отметили уменьшение пролиферации фибробластов через 6 и 9 дней, тогда как TheraCal значительно увеличил пролиферацию фибробластов только через 6 дней, но в меньшей степени, чем Biodentine (рис. 4A). Наконец, TheraCal и Xeno III не повлияли на колонизацию фибробластов области повреждения (рис. 4B, a–e).
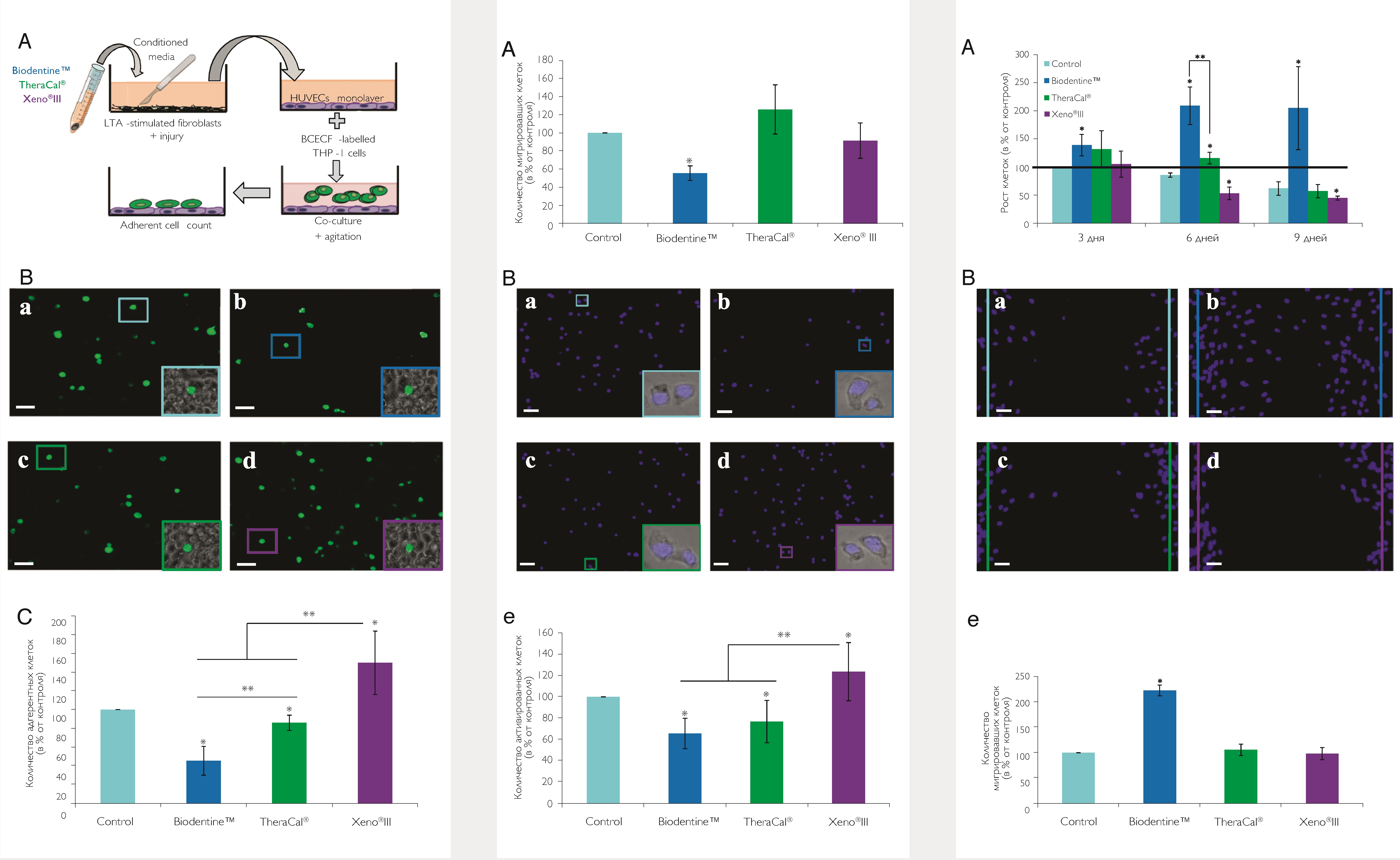
Рис. 2. Рис. 3. Рис. 4.
Рис. 2. Адгезия воспаленных THP-1 на эндотелиальных клетках (HUVEC). A – схематическое изображение адгезии клеток THP-1 при анализе HUVEC. Монослой HUVEC стимулировали в течение 4 ч надосадочной жидкостью из обработанных фибробластов, культивированных в течение 24 ч в разных средах MEM. Параллельно клетки THP-1 помечали кислотой BCECF в течение 1 ч. Обе клетки затем совместно культивировали в течение 30 мин при осторожном перемешивании для избежания прилипания клеток. После инкубации среды убирали, а адгезивные клетки THP-1 в слой эндотелиальных клеток подсчитали с помощью флуоресцентного микроскопа (Х100); B – изображения флуоресцентной микроскопии применили для анализа адгезии, показывающие: (a) – контроль, (b) – Biodentine, (c) – TheraCal и (d) – Xeno III. В обрамленных областях представлены адгезивные флуоресцентные клетки THP-1 на монослое эндотелиальных клеток. Колонки, 50 мм; C – количественная оценка адгезии THP-1 на эндотелиальных клетках. Biodentine и TheraCal значительно уменьшили адгезию клеток THP-1 на HUVEC по сравнению с контролем и с Xeno III, что привело к значительно лучшей адгезии. Количество прилипших клеток с Biodentine было значительно ниже, чем с TheraCal. Результаты выражены в процентах от контроля.
* Значительные различия по сравнению с контролем;
** существенные различия между двумя условиями (P < 0,05).
Рис. 3. Перенос и активация клеток THP-1. A – анализ миграции клеток THP-1 в камерах Бойдена показал, что Biodentine значительно уменьшил эту миграцию, на которую не повлиял TheraCal или Xeno III; B – анализ активации THP-1. Клетки THP-1 стимулировали в течение 24 ч супернатантами из обработанных фибробластов, инкубированных с кондиционированными или контрольными средами МЕМ в течение 24 ч. (a–d) Репрезентативные изображения на флуоресцентной микроскопии, показывающие: (a) – контроль, (b) – Biodentine, (c) – TheraCal и (d) – Xeno III. Обрамленные области показывают смещение фазово-контрастных и флуоресцентных изображений адгезивных клеток, что указывает на их трансформацию в макрофагоподобные клетки. Колонки, 200 мм, (d) – активация THP-1-клеток была значительно снижена с помощью TheraCal и Biodentine и значительно увеличилась с Xeno III. Результаты выражены в процентах от контроля.
* Значительная разница по сравнению с контролем;
** существенные различия между двумя условиями (P < 0,05).
Рис. 4. Пролиферация фибробластов пульпы человека и заживление ран после травмы. A – пролиферация фибробластов пульпы. Biodentine увеличивает распространение фибробластов во время инкубации. Увеличение пролиферации фибробластов наблюдалось с TheraCal через 6 дней, но в меньшей степени, чем с Biodentine. Xeno III уменьшил пролиферацию фибробластов через 6 и 9 дней; B – тесты на восстановление после травм провели на фибробластах, культивированных в течение 12 ч, с супернатантами из обработанных фибробластов. (a–d) Снимки, сделанные с флуоресцентным микроскопом: (a) – контроль, (b) – Biodentine, (c) – TheraCal и (d) – Xeno III. Две вертикальные линии очерчивают область, изначально лишенную клеток из-за травмы. Мигрирующие в эту область фибробласты подсчитали помощью флуоресцентного микроскопа. Колонки, 200 мм; (e) – количество клеток, мигрирующих в область повреждения, значительно увеличилось только с помощью Biodentine. Результаты выражены в процентах от контроля.
* Значительные различия с контролем;
** Значительные различия между двумя условиями (P < 0,05).
ОБСУЖДЕНИЕ
Результаты данного исследования подтверждают, что после имитации повреждения фибробластов пульпы и бактериальной инфекции, применение материала для прямого покрытия пульпы способствует уменьшению воспалительных процессов в этих клетках и заживлению пульпы. Оба процесса очень важны, потому что их баланс – это основа регенерации в условиях ограниченного пространства полости зуба. Это исследование показывает, что трикальций силикаты сдвигают равновесие к процессу заживления, а материалы, содержащие мономер, приводят этот баланс к воспалительной реакции.
Влияние этих материалов на реакцию фибробластов пульпы было исследовано на LTA-стимулированных и поврежденных фибробластах. Это служит моделью для некоторых клинических аспектов прямого покрытия пульпы, которые выполняют после кариозных повреждений пульпы, травмированной во время подготовки полости. Физическую травму рассмотрели в нескольких исследованиях в разных тканях с использованием наконечников пипеток или скальпелей.25,26 Поскольку большинство видов бактерий, вовлеченных в кариозный процесс, являются грамположительными, присутствие этих бактерий имитируется в этой работе путем инкубации фибробластов с LTA.11,21,27
В данном исследовании материалы были предварительно установлены и не были помещены в прямой контакт с клетками. Вместо этого, на клетки наносили элюаты этих атериалов. Действительно, некротическая зона образовалась в условиях in vivo из-за щелочного значения рН изза гидроксида кальция или материалов на основе трикальций силиката,28,29 в то время как элюаты материалов для покрытия достигли глубже лежащих жизнеспособных клеток.
Воспалительную активность изучали через влияние этих материалов на фибробласты пульпы на ранних стадиях воспаления, включая секрецию провоспалительных цитокинов, адгезию тучных клеток ТНР-1 на эндотелиальные клетки кровеносных сосудов, их миграцию и активацию при травме.
Действительно, хотя травмированные клетки инициируют воспалительную реакцию путем секреции воспалительных цитокинов, данное исследование демонстрирует, что применение материалов для покрытия на этих клетках снижает выделение цитокинов. Все материалы индуцировали значительное выделение IL-6 и VEGF. IL-6 считается мощным цитокином, играющим важную роль в процессе острого воспаления,30 и VEGF, как известно, увеличивает проницаемость сосудов.31 Это позволяет воспаленным клеткам прилипать к эндотелиальным клеткам кровеносных сосудов и мигрировать к месту повреждения, где эти клетки активируются.
Уровень секреции IL-6 и VEGF был значительно выше с материалами, содержащими мономер, чем с Biodentine. Это подтверждается тем фактом, что Xeno III значительно индуцирует адгезию THP-1 к эндотелиальным клеткам и их активацию. Это отражает стимуляцию воспалительной реакции и подтверждает воспалительный потенциал материалов, содержащих мономер, при непосредственном применении на комплексе тканей дентина и пульпы. Напротив, результаты данного исследования показывают, что уровень секреции воспалительных IL-6 и VEGF с Biodentine был значительно ниже, чем при применении содержащих мономер материалов.
Это может быть связано со значительным снижением адгезии THP-1 к эндотелиальным клеткам и их уменьшенной миграцией и активацией. Результаты свидетельствуют о потенциале Biodentine как ингибиторе воспалительного процесса.
Данное исследование подтверждает, что Biodentine увеличивает секрецию FGF-2 и TGF-b1, что может быть связано со стимуляцией пролиферации фибробластов и индукцией их миграции к месту повреждения при скретч-анализе. Напротив, Xeno III уменьшал секрецию TGF-b1 и уменьшал пролиферацию фибробластов. Это соответствует предыдущим работам, в которых сообщалось об участии FGF-2 и TGF-b1 в неоангиогенезе во время процесса заживления4 и их вовлечение в пролиферацию фибробластов пульпы и стволовых клеток.21
TheraCal, который содержит мономер и силикаты, увеличивал секрецию цитокинов IL-6 и VEGF при воспалении, как это наблюдается у Xeno III. Но в отличие от Xeno III, TheraCal уменьшала воспалительную клеточную адгезию на эндотелиальных клетках и их активацию, но в меньшей степени, чем Biodentine. TheraCal не влиял на пролиферацию фибробластов (за исключением 6 дней) и не вызывал их миграции. Эти результаты очень близки к полученным с Xeno III и предполагается, что добавление смол на клеточном уровне изменяет свойства биологически активного силиката в контексте воспаления пульпы и целебного баланса.
В совокупности результаты данного исследования показывают, что, хотя Biodentine уменьшает воспаление, он вызывает секрецию факторов роста, участвующих в процессе заживления. Эти результаты соответствуют ранее опубликованным исследованиям культур зубов человека, в которых Biodentine индуцировал высокий потенциал минерализации в пульпе с повышенным образованием сиалопротеина дентина и нестина, что указывает на способность к дифференциации одонтобласта и минерализации. Напротив, снижение присутствия этих маркеров и дезорганизованная и рассеянная минерализация была получена с TheraCal в ткани пульпы.16
Более того, данное исследование дает объяснение последствий добавления мономера к трикальций силикатам на клеточном уровне. По-видимому, токсичность мономера инициирует воспалительную реакцию внутри пульпы, которая находится в крайне ограниченном пространстве. Эта реакция может быть фатальной для процесса регенерации пульпы. Действительно TheraCal приводит к дезорганизации ткани пульпы без образования организованного дентинного мостика, тогда как хорошо организованный и мощный мостик формируется с Biodentine.32 Было обнаружено, что отсутствие минерализации может быть вызвано высвобождением мономеров, которые, помимо их токсичности33,34 ингибируют дифференциацию и минерализацию пульпы.35
В целом, эта работа подчеркивает тот факт, что выбор материала для покрытия пульпы имеет первостепенное значение в процедурах прямого покрытия пульпы. Действительно, усиление воспалительной реакции в замкнутой среде может привести к некрозу пульпы, дезорганизации и замедлению процессов заживления и регенерации.
Несмотря на уменьшение времени отверждения трикальция силиката на основе мономера данное исследование in vitro не поддерживает использование материалов, содержащих мономер, для прямого покрытия пульпы. Результаты показали, что добавление мономера ухудшает биоактивные свойства трикальций силикатов.
Авторы благодарят д-ра Жан-Шарля Гардона за предоставление зубов. Данное исследование было проведено при поддержке университета Экс-Марсель и Национального центра научных исследований Франции CNRS. Все авторы указывают на отсутствие конфликтов интересов.
Литература
- Massler M. Pulpal reactions to dental caries. Int Dent J 1967;17:441–60.
- 2. Ley K, Laudanna C, Cybulsky MI, et al. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat Rev Immunol 2007;7:678–89.
- Rombouts C, Giraud T, Jeanneau C, et al. Pulp vascularization during tooth development, regeneration, and therapy. J Dent Res 2017;96:137–44.
- Tran-Hung L, Laurent P, Camps J, et al. Quantification of angiogenic growth factors released by human dental cells after injury. Arch Oral Biol 2008;53:9–13.
- Roberts-Clark DJ, Smith AJ. Angiogenic growth factors in human dentine matrix. Arch Oral Biol 2000;45:1013–6.
- Cassidy N, Fahey M, Prime SS, et al. Comparative analysis of transforming growth factor-b isoforms 1–3 in human and rabbit dentine matrices. Arch Oral Biol 1997;42:219–23.
- Laurent P, Camps J, About I. BiodentineTM induces TGF-b1 release from human pulp cells and early dental pulp mineralization. Int Endod J 2012;45:439–48.
- Mathieu S, Jeanneau C, Sheibat-Othman N, et al. Usefulness of controlled release of growth factors in investigating the early events of dentin-pulp regeneration. J Endod 2013;39:228–35.
- Shimabukuro Y, Ueda M, Ozasa M, et al. Fibroblast growth factor-2 regulates the cell function of human dental pulp cells. J Endod 2009;35:1529–35.
- Rufas P, Jeanneau C, Rombouts C, et al. Complement C3a mobilizes dental pulp stem cells and specifically guides pulp fibroblast recruitment. J Endod 2016;42:1377–84.
- Jeanneau C, Rufas P, Rombouts C, et al. Can pulp fibroblasts kill cariogenic bacteria? Role of complement activation. J Dent Res 2015;94:1765–72.
- Chmilewsky F, Jeanneau C, Laurent P, et al. Pulp progenitor cell recruitment is selectively guided by a C5a gradient. J Dent Res 2013;92:532–9.
- Giraud T, Rufas P, Chmilewsky F, et al. Complement activation by pulp capping materials plays a significant role in both inflammatory and pulp stem cells’ recruitment.J Endod 2017;43:1104–10.
- Tran XV, Gorin C, Willig C, et al. Effect of a calcium-silicate-based restorative cement on pulp repair. J Dent Res 2012;91:1166–71.
- Nowicka A, Lipski M, Parafiniuk M, et al. Response of human dental pulp capped with biodentine and mineral trioxide aggregate. J Endod 2013;39:743–7.
- Jeanneau C, Laurent P, Rombouts C, et al. Light-cured tricalcium silicate toxicity to the dental pulp. J Endod 2017;43:2074–80.
- Lee H, Shin Y, Kim SO, et al. Comparative study of pulpal responses to pulpotomy with ProRoot MTA, RetroMTA, and TheraCal in dogs’ teeth. J Endod 2015;41:1317–24.
- Klos A, Tenner AJ, Johswich KO, et al. The role of the anaphylatoxins in health and disease. Mol Immunol 2009;46:2753–66.
- Chmilewsky F, Jeanneau C, Dejou J, et al. Sources of dentin-pulp regeneration signals and their modulation by the local microenvironment. J Endod 2014;40: S19–25.
- Tran-Hung L, Mathieu S, About I. Role of human pulp fibroblasts in angiogenesis. J Dent Res 2006;85:819–23.
- Chmilewsky F, Jeanneau C, Laurent P, et al. Pulp fibroblasts synthesize functional complement proteins involved in initiating dentin-pulp regeneration. Am J Pathol 2014;184:1991–2000.
- About I, Bottero MJ, de Denato P, et al. Human dentin production in vitro. Exp Cell Res 2000;258:33–41.
- Tsuchiya S, Yamabe M, Yamaguchi Y, et al. Establishment and characterization of a human acute monocytic leukemia cell line (THP-1). Int J Cancer 1980;26:171–6.
- Jia M, Shi Z, Yan X, et al. Insulin and heparin-binding epidermal growth factor-like growth factor synergistically promote astrocyte survival and proliferation in serum-free medium. J Neurosci Methods 2018;S0165-0270(18):30172–9.
- Rajan TS, Diomede F, Bramanti P, et al. Conditioned medium from human gingival mesenchymal stem cells protects motor-neuron-like NSC-34 cells against scratch-injury-induced cell death. Int J Immunopathol Pharmacol 2017;30:383–94.
- Loov C, Shevchenko G, Nadadhur AG, et al. Identification of injury specific proteins in a cell culture model of traumatic brain injury. PLoS One 2013;8:e55983.
- Keller JF, Carrouel F, Colomb E, et al. Tolllike receptor 2 activation by lipoteichoic acid induces differential production of pro-inflammatory cytokines in human odontoblasts, dental pulp fibroblasts and immature dendritic cells. Immunobiology 2010;215:53–9.
- Tecles O, Laurent P, Aubut V, et al. Human tooth culture: a study model for reparative dentinogenesis and direct pulp capping materials biocompatibility. J Biomed Mater Res B Appl Biomater 2008;85:180–7.
- Aeinehchi M, Eslami B, Ghanbariha M, et al. Mineral trioxide aggregate (MTA) and calcium hydroxide as pulp-capping agents in human teeth: a preliminary report. Int Endod J 2003;36:225–35.
- Heinrich PC, Castell JV, Andus T. Interleukin-6 and the acute phase response. Biochem J 1990;265:621–36.
- Hippenstiel S, Krull M, Ikemann A, et al. VEGF induces hyperpermeability by a direct action on endothelial cells. Am J Physiol 1998;274:L678–84.
- Bakhtiar H, Nekoofar MH, Aminishakib P, et al. Human pulp responses to partial pulpotomy treatment with TheraCal as compared with Biodentine and ProRoot MTA: a clinical trial. J Endod 2017;43:1786–91.
- Hume WR, Gerzina TM. Bioavailability of components of resin-based materials which are applied to teeth. Crit Rev Oral Biol Med 1996;7:172–9.
- Ratanasathien S, Wataha JC, Hanks CT, et al. Cytotoxic interactive effects of dentin bonding components on mouse fibroblasts. J Dent Res 1995;74:1602–6.
- About I, Camps J, Mitsiadis TA, et al. Influence of resinous monomers on the differentiation in vitro of human pulp cells into odontoblasts. J Biomed Mater Res 2002;3:418–23.
► 36